Pada umumnya hubungan antara laju reaksi dengan konsentrasi zat-zat pereaksi hanya diturunkan dari data eksperimen. Bilangan pangkat yang menyatakan hubungan konsentrasi zat pereaksi dengan laju reaksi disebut orde reaksi.
k = tetapan laju reaksi
[A] = konsentrasi zat A dalam mol per liter
[B] = konsentrasi zat B dalam mol per liter
m = orde reaksi terhadap zat A
n = orde reaksi terhadap zat B
Beberapa contoh reaksi dan rumus laju reaksi yang diperoleh dari hasil eksperimen dapat dilihat pada Tabel berikut:
Tabel : Contoh beberapa reaksi dan rumus laju reaksinya
 orde reaksi terhadap H2 = orde satu, orde reaksi terhadap NO = orde dua, dan orde reaksi total adalah tiga. Untuk lebih memahami cara menentukan orde reaksi dan rumus laju reaksi Orde reaksi dapat juga ditentukan melalui kecenderungan dari data suatu percobaan yang digambarkan dengan grafik. Berikut ini dijelaskan penentuan orde reaksi melalui grafik.
orde reaksi terhadap H2 = orde satu, orde reaksi terhadap NO = orde dua, dan orde reaksi total adalah tiga. Untuk lebih memahami cara menentukan orde reaksi dan rumus laju reaksi Orde reaksi dapat juga ditentukan melalui kecenderungan dari data suatu percobaan yang digambarkan dengan grafik. Berikut ini dijelaskan penentuan orde reaksi melalui grafik.
1. Grafik Orde Nol
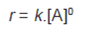 Bilangan dipangkatkan nol sama dengan satu sehingga persamaan laju reaksi menjadi: r » k. Jadi, reaksi dengan laju tetap mempunyai orde reaksi nol. Grafiknya digambarkan seperti Grafik diatas.
Bilangan dipangkatkan nol sama dengan satu sehingga persamaan laju reaksi menjadi: r » k. Jadi, reaksi dengan laju tetap mempunyai orde reaksi nol. Grafiknya digambarkan seperti Grafik diatas.
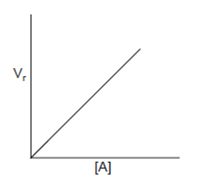
2. Grafik Orde Satu
Gambar 4.9 Hubungan kecepatan dengan konsentrasi
Untuk orde satu, persamaan laju reaksi adalah :
Persamaan reaksi orde satu merupakan persamaan linier berarti laju reaksi berbanding lurus terhadap konsentrasinya pereaksinya. Jika konsentrasi pereaksinya dinaikkan misalnya 4 kali, maka laju reaksi akan menjadi 41 atau 4 kali lebih besar.
3. Grafik Orde Dua
Persamaan laju reaksi untuk reaksi orde dua adalah:








Tidak ada komentar:
Posting Komentar